Quais os benefícios de aprovar um medicamento antes de confirmar que ele funciona superam os custos potenciais?
A Food and Drug Administration desencadeou uma tempestade de debates ao aprovar um novo medicamento, o aducanumabe, para a doença de Alzheimer, por meio de uma via de aprovação acelerada. Esta decisão ignorou a recomendação do painel consultivo externo do FDA para rejeitar o medicamento.
O FDA concede aprovações aceleradas para medicamentos para tratar doenças graves para as quais não há tratamentos conhecidos, ou pelo menos muito poucos. O tipo de dados usados para apoiar as aprovações aceleradas é muito diferente dos dados de segurança e eficácia de referência típicos necessários para a aprovação. Como farmacêutico e pesquisador , documentei várias razões pelas quais a pesquisa de medicamentos conduzida em um ambiente de laboratório difere substancialmente do que é visto nas pessoas. O desafio está em encontrar um equilíbrio entre reservar um tempo para garantir que o tratamento funcione e atender às necessidades urgentes do paciente.
Usando um padrão diferente
O FDA criou um caminho de aprovação acelerado para medicamentos que tratam doenças graves, para as quais muitos pacientes sentem uma necessidade desesperada de mais opções. Isso inclui tratamento para câncer em estágio avançado, esclerose múltipla e HIV , entre outros.
Ao considerar a aprovação acelerada, a agência examina a eficácia de um medicamento usando o que é chamado de " desfecho substituto ". Enquanto a maioria dos testes de medicamentos medem o sucesso com base em desfechos clínicos que determinam se um medicamento ajuda as pessoas a se sentirem melhor ou a viver mais, como reduzir ataques cardíacos ou derrames, os desfechos substitutos medem biomarcadores que sugerem benefício clínico potencial. Esses desfechos substitutos são substitutos viáveis para desfechos clínicos rígidos porque estão comprovadamente vinculados aos resultados clínicos desejados. Por exemplo, os desfechos clínicos de redução de ataques cardíacos e derrames podem usar a redução da pressão arterial e o colesterol de lipoproteína de baixa densidade (LDL) como desfechos substitutos.
Nossa missão é compartilhar conhecimento e informar decisões.
Embora muitas hipóteses sobre os desfechos substitutos corretos para tratar certas doenças tenham se revelado, várias outras mostraram-se erradas ou apenas parcialmente corretas. Um grande exemplo é a homocisteína , um aminoácido que se pensava ser um indutor de doenças cardiovasculares e que, desde então, demonstrou ser apenas um marcador de doença . Pessoas com níveis elevados de homocisteína são mais propensos a ter doenças cardiovasculares, mas baixar os níveis não torna os ataques cardíacos e derrames menos prováveis de ocorrer. Todos aqueles que apressaram a ciência e compraram suplementos dietéticos para reduzir sua homocisteína estavam jogando seu dinheiro pelo ralo.
Testando a hipótese de beta amilóide
Embora o efeito do aducanumabe, o medicamento para Alzheimer desenvolvido pela empresa de biotecnologia Biogen, em desfechos clínicos rígidos sejam fracos , ele demonstrou reduzir a formação de placas beta amilóides em pacientes com Alzheimer em estágio inicial. A beta amilóide denota proteínas que se agrupam para formar placas comumente vistas em pacientes com Alzheimer. Foi levantada a hipótese de que essas placas impulsionam os sinais e sintomas do Alzheimer. Modelos animais demonstraram que interferir na formação da placa beta amilóide pode levar a melhorias no funcionamento.
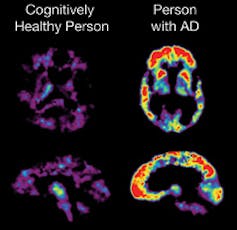
Os dados que ligam as placas de beta amilóide a desfechos clínicos rígidos não são um acerto. Ao contrário da hipertensão e do colesterol LDL elevado , que comprovadamente estão associados a eventos cardiovasculares, o beta amilóide não obteve resultados tão definitivos.
Foram realizados dois grandes ensaios clínicos avaliando o aducanumabe, um que começou com uma dose mais alta e outro que começou com uma dose mais baixa que foi aumentada posteriormente. Ambos os ensaios foram interrompidos precocemente, e o ensaio de dose mais baixa não encontrou benefícios. O estudo de dose mais alta encontrou benefícios modestos na manutenção do funcionamento mental, mas o estudo não teve pacientes suficientes para mostrar que esses benefícios eram devidos à droga e não ao acaso. Após o fato, os pesquisadores combinaram dados de pacientes que receberam altas doses de aducanumabe em ambos os ensaios e encontraram uma melhora no funcionamento mental . No entanto, muitos especialistas que realizam testes clínicos se irritam com a combinação de resultados de testes como este: Essas análises após os fatos demonstraram, em algumas circunstâncias, não dar certo no futuro .
Outros fármacos experimentais inicialmente promissores visando a beta amiloide para Alzheimer também não conseguiram reduzir os desfechos clínicos difíceis em seus ensaios clínicos. Depois que um desses medicamentos, o solanezumabe, não atingiu os objetivos do estudo, a análise de dados adicionais pós-ensaio sugeriu que ele poderia ser eficaz em uma população selecionada com Alzheimer leve. Os pesquisadores conduziram um grande ensaio clínico adicional com foco nessa subpopulação, mas novamente não conseguiram demonstrar benefícios significativos . Ninguém sabe se o aducanumabe encontrará benefícios significativos quando o novo ensaio clínico for concluído ou se falhará como o solanezumabe.
Se a beta amilóide for simplesmente um marcador e não uma causa do Alzheimer, será um erro caro: o aducanumabe está estimado em mais de US $ 56.000 por ano .
A decisão do FDA foi um erro?
Mais de 6 milhões de americanos têm a doença de Alzheimer, e as mortes causadas pelo mal de Alzheimer aumentaram mais de 145% nos últimos 20 anos. A doença de Alzheimer não apenas rouba a autonomia dos indivíduos, mas também representa um enorme fardo para os membros da família e para a economia dos Estados Unidos: US $ 355 bilhões são gastos anualmente no cuidado de pessoas com Alzheimer. Os tratamentos atuais aprovados pela FDA são apenas modestamente eficazes no controle dos sintomas da doença e nenhum visa uma possível causa subjacente.
A via de aprovação acelerada permite que pacientes com Alzheimer em estágio inicial tenham acesso ao aducanumabe enquanto um ensaio clínico maior e mais definitivo é realizado. A Biogen diz que espera ter o teste clínico concluído até 2030 . Se o estudo não encontrar reduções nos desfechos clínicos rígidos, o medicamento será retirado.

Se o aducanumabe for finalmente considerado eficaz , muitos pacientes com Alzheimer em estágio inicial colherão os benefícios da redução nas hospitalizações, consultas médicas, custos com asilos e encargos sociais.
Se o aducanumabe for considerado ineficaz, no entanto, o Medicare, as seguradoras e os pacientes terão gasto dezenas de milhões de dólares em um medicamento que não só não funcionou, mas também expôs os pacientes a eventos adversos, incluindo o risco de sangramento no cérebro. .
Os médicos devem prescrever aducanumabe e as seguradoras devem pagar por ele?
Para pacientes nos estágios iniciais da doença de Alzheimer, há razão para tentar aducanumabe com base nos dados de ensaios clínicos atuais e na falta de alternativas. Mas na doença avançada, é improvável que o aducanumabe ou qualquer medicamento direcionado à beta amilóide proporcione benefícios.
Em uma avaliação de custo-benefício do aducanumabe, o Institute for Clinical and Economic Review , uma organização independente que avalia o valor dos tratamentos médicos, sugeriu uma faixa de preço anual de $ 8.300 a $ 23.000. Isso está muito longe dos US $ 56.000 por ano que a empresa espera cobrar , e isso não leva em conta os milhares de dólares em testes adicionais necessários para reduzir o risco de inchaço e sangramento no cérebro.
O custo anual do medicamento provavelmente excederá em muito a economia de custos em outras áreas, como redução de consultas médicas e hospitalizações. Até que mais resultados sejam divulgados, tais custos elevados podem levar as seguradoras privadas a não cobrir ou cobrar co-pagamentos mais altos pelo medicamento. Dada a idade média das pessoas com doença de Alzheimer, no entanto, a maioria das pessoas que recebem aducanumabe se qualificará para o Medicare e provavelmente terá cobertura. Se a droga realmente tratará a doença - o maior problema em questão - permanece incerto.
O mundo torce para que a aposta do FDA valha a pena.
Distinto Professor e Chefe do Departamento de Prática Farmacêutica da Universidade de Connecticut
Originalmente Publicado por: The Conversation











